|
|
У разі взаємодії корозійних середовищ з металами та сплавами спостерігається кілька видів корозії, які класифікують за такими ознаками, як: механізм взаємодії, умови взаємодії тощо.
За механізмом взаємодії зовнішнього середовища з металами і сплавами корозію поділяють на хімічну та електрохімічну.
Хімічною корозією називають руйнування виробів, виготовлених з металів та сплавів, у середовищах-неелектролітах.
Прикладом такого виду корозії є руйнування деталей нагрівних печей, казанів, турбін, двигунів внутрішнього згоряння, сопел реактивних двигунів тощо. У разі взаємодії газового середовища (пічні та викидні гази) з металевими виробами на їх поверхні утворюються різні хімічні сполуки (наприклад, оксиди, сульфіди тощо) у вигляді плівок.
Чим вища температура середовища, тим інтенсивніше кородує метал, оскільки зростають швидкість дифузії газів через плівку до металу і зустрічна дифузія атомів металу. У разі утворення не дуже щільної та міцної плівки газове середовище може різко прискорити руйнування виробів. Прикладом металів, на поверхні яких утворюється нещільна (крихка) оксидна плівка, є залізо, вуглецеві сталі та чавуни. Вони надзвичайно швидко руйнуються під дією газових середовищ, оскільки їх оксидні плівки неміцні, а в разі незначної зміни температури або навантаження ці плівки відшаровуються. Поверхня виробу „оголюється”, і кисень чи інший газ знову взаємодіє з металом виробу. З часом виріб тоншає, оскільки утворена плівка знову обсипається.
Отже, оксидні плівки, які утворюються на поверхні виробів, виготовлених з вуглецевих сталей і чавунів, не можуть захистити їх від корозійного руйнування. Те саме спостерігається з деталями, приладами та механізмами, виготовленими з ніобію, молібдену, вольфраму, які працюють в атмосфері повітря чи кисню за температур 400-5000С.
Якщо на поверхні виробів утворюються міцні та щільні оксидні плівки, то корозійне руйнування сповільнюється. Прикладом таких металів є хром, алюміній та сплави на їх основі. Саме тому на практиці використовують леговані сталі, які витримують дію газових середовищ до 9000С, у той час як вуглецеві легко руйнуються за температур понад 5000С. Легування сталі хромом, алюмінієм, нікелем підвищує корозостійкість сталей до температури 850-9000 С.
Рідини-неелектроліти руйнують нафтопроводи й обладнання каталізного і термічного крекінгів нафтопродуктів та інші металеві вироби. Швидкість корозії в рідинах-неелектролітах (спирти, бензин, гас, нафта тощо) невелика, але зростає за наявності в них домішок, особливо сірки та кисню й за підвищення температури середовища. Швидкість корозії чорних металів за наявності вологого хлористого водню становить 5-20 мм/рік, а спільна наявність Н2S і НCl підсилює корозію в 3-4 рази . Найбільш інтенсивно процеси корозії протікають у конденсаторах-холодильниках, верхній частині ректифікаційних колон, трубопроводах гарячих залишків (мазуту). Наприклад, за даними однієї з нафтових компаній у США, корозія апаратури нафтопереробних заводів від солей, що містяться в емульсійних нафтах, завдає збитків, що становлять 125 млн. доларів у рік.
Рідини неорганічного походження агресивні, тому важливо не помилитись у виборі матеріалу для виготовлення конструкцій або захисного покриття. Так, для рідин із вмістом брому придатне обладнання, виготовлене з танталу, а із вмістом сірки – з алюмінію.
Електрохімічною корозією називають руйнування виробів, виготовлених з металів і сплавів у середовищах-електролітах.
Це найпоширеніший вид корозії. Електрохімічна корозія характеризується протіканням електричного струму в електроліті, переходом атомів металу в іонізований стан та іншими електрохімічними процесами. Прикладом електрохімічної корозії є руйнування металевих конструкцій і виробів, які перебувають у середовищі вологого повітря, в морській та річковій воді тощо.
Якщо в контакті з електролітом перебувають два метали, то механізм корозії нагадує роботу гальванічного елемента, в якому метал із меншим електродним потенціалом (анод) безперервно розчиняється, а з більшим (катод) – відновлюється.
Запишемо ряд металів, розміщених у порядку зменшення їх електродних потенціалів (табл.5.2).
Таблиця 5.2- Електродні потенціали металів
Метал |
Au |
Pt |
Ag |
Cu |
H |
Sn |
Ni |
Fe |
Zn |
Електродний
потенціал |
+1,42 |
+1,20 |
+0,80 |
+0,34 |
0 |
-0,14 |
-0,25 |
-0,44 |
-0,76 |
Якщо в розчин сірчаної кислоти (середовище-електроліт) помістити пластини, виготовлені з міді та цинку і з’єднати їх зовнішні кінці електричним провідником (рис.5.15), то утвориться гальванічний елемент, в якому мідь, що має більший електродний потенціал (+0,34), ніж цинк (-0,76), не розчиняється, а є лише місцем нейтралізації іонів електроліту. Позитивно заряджені іони цинку (Zn2+) перейдуть в електроліт, а електрони потечуть по зовнішньому електричному провіднику до мідної пластинки, де нейтралізують позитивно заряджені іони водню (H+).
Атоми водню з’єднуються в молекули (H2) і у вигляді бульбашок виходять з розчину електроліту. Ця модель дає можливість пояснити причину руйнування поверхні металу, який має неоднорідну будову (різні компоненти, фази, неметалеві включення, зони з різними залишковими напруженнями тощо).
Рисунок 5.15 - Схема процесів, які відбуваються
в гальванічному елементі
Процес електрохімічної корозії (утворення гальванічних елементів) також можна простежити на наступній схемі (рис.5.16). Якщо неоднорідний метал (наприклад, залізо плюс включення) помістити в електроліт (наприклад, розчин соляної кислоти), то іони більш активного металу будуть переходити в розчин. Область стінки, поверхня якої є анодом, буде руйнуватися. Негативні іони електроліту (у даному випадку іони хлору) переміщуються в напрямку виділення позитивних іонів металу і при взаємодії з ними утворюють хлористу сіль металу. В той же час позитивні частинки електроліту (водень) переміщуються до негативно заряджених ділянок стінки, нейтралізуються і утворюють молекулу водню.
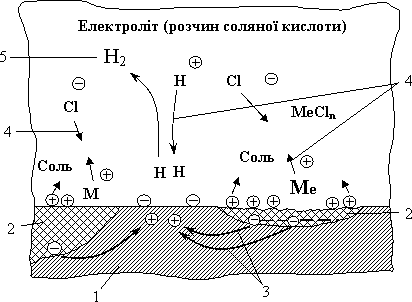
Рисунок 5.16- Схема електрохімічної корозії
1- метал, більш стійкий до корозії; 2 – метал, менш стійкий, який утворює в електроліті анодні ділянки; 3- потік електронів усередині металу; 4- потік іонів в електроліті; 5- нейтральні молекули водню
Отже, поверхня металу - це множина мікроелементів (анодних і катодних ділянок), коротко замкнених через сам метал. Кожна ділянка має певний електродний потенціал.
Робота мікрогальванічних пар починається під час контакту з електролітом: ділянки сплаву з меншим потенціалом (аноди) руйнуються, а з більшим (катоди) – залишаються без змін.
Однофазні сплави стійкіші в середовищах-електролітах, ніж багатофазні, але менш стійкі, ніж чисті метали.
Швидкість корозійного руйнування тим більша, чим далі стоять один від одного метали у ряді електродних потенціалів.
При електрохімічному корозійному процесі величина корозійних втрат металу (кількість розчиненого металу), згідно закону Фарадея, пропорційна корозійному струму:
 (5.35) (5.35)
де I - корозійний струм, а;
Ф - стала Фарадея, дорівнює 96500 Кулонам;
А - атомна вага металу;
n - валентність іона металу, що переходить у розчин;
- тривалість корозії.
Виникнення корозійних ділянок обумовлюється не тільки неоднорідністю металу, але і багатьма іншими причинами: неоднаковими деформаціями та напруженнями в різних ділянках, неоднорідністю концентрації електроліту, різними температурами окремих ділянок тощо.
Залежність швидкості розчинення сталі від концентрації різних кислот та від величини температури показана на рис. 5.17 та 5.18. З цих графіків видно, що швидкість розчинення металу в соляній кислоті зростає із збільшенням її концентрації, а в сірчаній та азотній кислотах спочатку спостерігається зростання, а потім зменшення швидкості розчинення. З підвищенням температури швидкість корозії збільшується.
За умовами взаємодії, тобто в залежності від умов, в яких працюють машини, агрегати та перебувають металеві конструкції, розрізняють кілька видів корозії: газову, атмосферну, підземну, біологічну, корозію під дією струмів тощо.
Газова корозія металів та сплавів відбувається в газах за високих температур. Виникає в основному при дії на метали викидних і промислових газів та теплоти, оскільки ці гази завжди нагріті до високих температур.
У разі атмосферної корозії агресивним середовищем є сконцентрована на поверхні металевого виробу волога, агресивність якої зростає із збільшенням в ній газів: О2, СО2, SO2 тощо. Цей вид корозії найпоширеніший, оскільки близько 80% металовиробів та конструкцій експлуатується і зберігається під „відкритим небом”.
У разі підземної (ґрунтової) корозії середовищем, яке руйнує металеві конструкції (труби, кабелі та інші підземні комунікації), є ґрунтова волога. Швидкість корозії зростає в торф’янистих і болотистих грунтах.
Наявність мікроорганізмів і продуктів їх життєдіяльності руйнує навіть захисні покриття конструкцій.
Вивчення морських глибин, добування нафти з дна морів, створення потужного надводного та підводного морського флоту призводять до великих втрат металів у дуже агресивному середовищі, яким є морська вода. Вода, крім хлоридів металів, містить кисень та інші речовин, які спричиняють корозію.
Великих втрат завдає корозія під дією блукаючих струмів. Особливо небезпечним є постійний струм. Спостерігається цей вид корозії навколо трамвайних ліній і ліній електропоїздів. Під час руху трамваїв та електропоїздів частина електричного струму проникає в грунт, доходить до труб, якими транспортують нафту, воду, газ, та інших підземних металевих конструкцій, анодні ділянки яких руйнуються. Це дуже небезпечний вид корозії: струм силою 1 А за рік „з’їдає” 9 кг заліза, 3 кг алюмінію, 11 кг цинку і міді, 34 кг свинцю. Радіус дії цього виду корозії досягає десятків кілометрів.
Види корозійного руйнування. Корозійне руйнування металів і сплавів починається з поверхні, тобто на межі металевий виріб – середовище, і поступово поширюється в глибину металу.
Найпоширеніші види корозійного руйнування металів і сплавів – суцільне, місцеве (рис. 5.19).
При суцільному руйнуванні середовище взаємодіє з металевими виробами по всій поверхні, але з різною швидкістю. Саме тому цей вид руйнування поділяють на рівномірне руйнування та нерівномірне. У разі рівномірного руйнування (рис.5.19.1) швидкість взаємодії середовища з металом однакова, а в разі нерівномірного – різна на різних ділянках поверхні виробів. Відповідно середовище поширюється в глибину металу на однакову або різні відстані.
Місцеве руйнування – руйнування, за яким середовище взаємодіє з металами на окремих ділянках поверхні виробів.
Місцеве руйнування поділяють на плямисте, виразкове, точкове, підповерхневе, вибіркове, міжкристалітне, транскристалітне тощо.
Рисунок 5.19 - Види корозійного руйнування
1- рівномірне; 2- плямисте; 3- виразкове; 4- підповерхневе; 5- міжкристалітне; 6-транскристалітне
Плямисте руйнування (рис.5.19.2) спостерігається на виробах, виготовлених з латуні, які перебували в морській воді. На поверхні латунних виробів утворюються плями. Глибина плям невелика.
Якщо середовище проникає на велику глибину, то кажуть, що має місце виразкове руйнування (рис.5.19.3). Так руйнується сталь, вироби з якої довгий час перебували у грунті.
Точкове руйнування характеризується утворенням вузьких кратероподібних (аж до наскрізних) заглиблень. Цей вид руйнування спостерігається на поверхні виробів, виготовлених із нержавіючої сталі, після дії на них морської води.
Підповерхневе руйнування (рис.5.19.4) спостерігається тоді, коли вироби покриті лаком, фарбою тощо. Продукти корозійного руйнування не можуть виноситися в середовище, оскільки поверхня виробу покрита покриттям. Це спричиняє здуття покриття та розшарування металу.
Суть вибіркового руйнування полягає в тому, що середовище взаємодіє з певними хімічними елементами або фазами матеріалів, з яких виготовлені вироби. Так, у сірих чавунах руйнується ферит і перліт, а графітовий каркас залишається; у латунях середовище взаємодіє із цинком і приповерхневий шар латунних виробів складається з губчастої міді.
Міжкристалітне руйнування (рис.5.19.5). Середовище взаємодіє спочатку з домішками, які перебувають на межах кристалів, а потім приступає до розчинення металів. Це дуже небезпечний вид руйнування, який може спричинити раптову аварію. Це саме стосується також транскристалітного руйнування (рис.5.19.6).
|
 (5.35)
(5.35)

