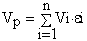|
|
Проблемою захисту металів і сплавів від корозії вчені займаються давно. Проте й досі вона є і залишається актуальною; з’являються нові корозійні середовища, а також нові конструкційні матеріали.
Найпоширенішими способами захисту металів і сплавів від корозії є легування (створення сплавів з антикорозійними властивостями), захисні покриття (металеві, дифузійні, неметалеві), використання інгібіторів тощо.
Вибір того чи іншого способу захисту визначається умовами експлуатації деталей, механізмів, приладів технологічного обладнання.
Легування. Технологічне обладнання, виготовлене з вуглецевих сплавів (чавунів, сталей), має малу корозостійкість в агресивних середовищах. Щоб збільшити корозостійкість цих конструкційних матеріалів, їх легують хромом, нікелем, титаном та іншими хімічними елементами. На поверхні виробів, виготовлених з легованих сталей, утворюються щільні оксидні плівки, які захищають вироби від руйнування. До таких сталей належать хромисті та хромонікелеві.
Щоб запобігти появі міжкристалітного руйнування, до складу сталі додають титан. Хромонікелеві сталі більш корозостійкі, ніж хромисті. Їх широко використовують у хімічній промисловості. Хромонікелеві сталі, які містять 17% хрому та 9% нікелю, є корозостійкими на повітрі, в киплячих розчинах азотної та фосфорної кислот.
Нанесення антикорозійних покриттів. Легування є дорогим способом захисту металевих виробів від дії агресивних середовищ, оскільки дуже часто металеві вироби мають великі розміри, а легуючі елементи дорогі. Саме тому наносити покриття на поверхні металевих виробів економічно вигідніше.
Покриття є металеві, дифузійні і неметалеві.
Для захисту виробів металевими покриттями вибирають такі метали, які мають велику корозостійкість у середовищі. Покриття наносять на поверхні виробів тонким шаром різними способами: з розплавів, електрохімічним (електролізним) способом, розпиленням, плазмовим запиленням тощо.
За механізмом захисної дії металеві покриття поділяють на катодні й анодні.
Катодні покриття наносять з металів, які мають більший електродний потенціал у даному середовищі, ніж основний метал. Проте незначне порушення суцільності покриття (риски, тріщини, пори тощо) роблять його навіть шкідливим. У місця порушення суцільності покриття проникає агресивне середовище і утворюється гальванічна пара, в якій метал виробу виконує роль анода й швидко руйнується, наприклад, олов’яне покриття на поверхні виробу, виготовленого з вуглецевої сталі (рис.5.20 а). Крім олова, використовують мідь, нікель та інші метали.
Суть захисту металевих виробів анодним покриттям полягає в тому, що в середовищі саме покриття руйнується (рис. 5.20 б). Поверхню виробів покривають металами, які мають великий від’ємний електродний потенціал. У разі пошкодження покриття виникають гальванічні пари, в яких метал виробу виконує роль катода й не руйнується. Наприклад, для залізовуглецевих сталей такими покриттями є кадмієве, цинкове. Цинкові покриття широко використовують для захисту труб, резервуарів від дії води та гарячих рідин.
Дифузійні покриття дорожчі, ніж металеві, оскільки технологія їх нанесення складніша. Ці покриття використовують для захисту металевих виробів від дії агресивних середовищ, нагрітих до високих температур (наприклад, нагрівні елементи в електричних печах, газові турбіни тощо).
Найпростішим і відносно дешевим захистом металевих виробів від дії агресивних середовищ є нанесення неметалевих покрить, які поділяються на органічні та неорганічні покриття.
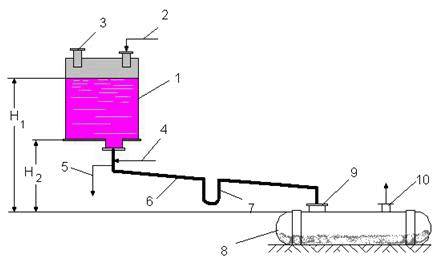
Рисунок 5. 20 – Схема корозійного руйнування покриття
а – олов’яного (катодного); б – цинкового (анодного)
До органічних покрить відносяться різні мінеральні мастила, вазелін, розчини парафінів, бітумів, лаки, фарби, смоли тощо. Порівняно з іншими видами покрить, їх легко наносити на поверхні виробів зануренням, розпиленням або за допомогою помазка. Лакофарбові покриття наносять звичайно в декілька шарів. Смоли наносять рідкими в нагрітому стані. Так наносять, наприклад, епоксидні та кремнійорганічні смоли. Покриття смолами здійснюється також за допомогою газополум’яного запилення (поліетилен, фторопласт), а також за допомогою футерівки листовим матеріалом (вінілпласт), гумою та ебонітом, що мають високу стійкість до агресивних середовищ.
До неорганічних покрить відносяться: цементні та бетонні покриття, що застосовуються для захисту від корозії металевих конструкцій (трубопроводів, резервуарів), силікатні емалі тощо.
Неметалеві покриття міцно зчеплені з поверхнею виробів, є корозостійкими і добрими електроізоляторами. Майже 90% усіх металевих виробів захищають від корозії за допомогою саме цих покриттів.
Зменшення агресивності середовища. Суть цього методу полягає у видаленні деяких реагентів, що наявні в навколишньому середовищі і викликають корозію, або в добавленні спеціальних речовин, які сповільнюють корозійні процеси. Такі речовини називаються інгібіторами (від лат. „inhibeo” – сповільнюю, зупиняю). Оскільки електрохімічна корозія є результатом двох взаємопов’язаних процесів – анодного та катодного, речовини, що добавляються, можуть сповільнювати процеси корозії, діючи на анодні та катодні реакції, а також одночасно на обидві.
Інгібітори, які діють вибірково, поділяють на анодні та катодні.
До анодних належать інгібітори, які мають окислювальні властивості (хромати, нітриди тощо) й утворюють на поверхні металу пасивні, переважно оксидні, плівки товщиною близько 0,01 мкм.
Катодні інгібітори гальмують корозійне руйнування, скорочуючи кількість катодних ділянок, або поглинають кисень, який перебуває в розчині.
Інгібітори застосовують для захисту металів і сплавів тільки в нейтральних і лужних середовищах.
Для захисту від дії атмосфери використовують легкі сповільнювачі, наприклад аміни. Їх вносять в атмосферу розпиленням або замочуванням паперу. Таким папером обгортають металеві вироби.
Інгібітори не універсальні, вони можуть захистити лише певні групи металів. Проте відомі інгібітори, які захищають як чорні, так і кольорові метали та сплави на їх основі. До них належить хроматдициклогексиламоній.
У розчинах з високою електропровідністю (наприклад, в морській воді) використовується електрохімічний захист від корозії. Цей спосіб захисту здійснюється за допомогою струму, що підводиться ззовні (катодний захист), або за допомогою приєднання до конструкції металу, який має більш від’ємний потенціал (протекторний захист).
Установки катодного захисту дозволяють створити різницю потенціалів між спорудою, яка захищається, та грунтом, за яким вся металева споруда стає катодом. Для виникнення різниці потенціалів від’ємний полюс джерела постійного струму сполучають із спорудою, що захищається, а позитивний через електроди-заземлювачі (анодне заземлення) - з грунтом (рис.5.21).
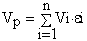
Рисунок 5.21 – Схема установки катодного захисту
-
джерело струму; 2- провід; 3- анодне заземлення;
4 – об’єкт, що захищається (труба)
Таким чином, вся поверхня металевої підземної споруди стає катодною і захищеною від корозійного руйнування. Для живлення установки катодного захисту може бути використане будь-яке джерело постійного струму. За умов якісної бітумної ізоляції поверхні ділянки, що захищається, одна катодна установка може захистити трубопровід протяжністю від 10 до 20 км або 5-10 резервуарів ємністю від 5 до 10 тис.м3 кожний.
Завдяки високій ефективності, економічності (напруга джерела струму приймається в межах 6-12 В, а густина захисного струму - від 2 до 20 мА на 1 м2 поверхні) катодний захист широко використовується, особливо для захисту від корозії магістральних газопроводів та нафтопроводів.
Протекторний захист повністю зберігає принцип катодного захисту, але в ньому відсутнє зовнішнє джерело електричного струму, що забезпечує його вибухобезпеку.
При протекторному захисті струм, необхідний для захисту, одержується в результаті створення штучних гальванічних пар, в яких катодом є метал, що захищається, а анодом спеціальний метал: цинк, магній, алюміній (рис.5.22). Наприклад, для захисту сталі в контакті з металевою конструкцією закріплюють цинкову пластину.
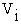
Рисунок 5.22 - Протекторний захист підземного трубопроводу
1 – трубопровід; 2 –автономні аноди (протектори);
3- з’єднувальні провідники
Метали, які використовуються в якості анодів, повинні бути дуже чистими, оскільки навіть незначна кількість домішок різко знижує їх захисну дію. Автономні аноди виготовляються різних форм (у виді пластин, стрижнів, труб тощо) і розміщуються на відстані від 1 до 5 м до об’єкту, який захищається.
Таким чином, головним і основним протипожежним способом захисту об’єктів та технологій є виявлення та попередження можливих причин пошкоджень і аварій технологічного обладнання.
Контрольні питання
1. Класифікація причин пошкодження технологічного обладнання.
2. Назвати причини підвищення тиску в апаратах.
3. Що таке порушення матеріального балансу для апаратів, за яких причин воно виникає і до яких наслідків може привести?
4. Причини та умови утворення в апаратах і трубопроводах полімерних, льодяних і кристалогідратних пробок. Заходи, що знижують цю небезпеку.
5. В чому полягає захист апаратів від переповнення?
6. Причини попадання низько киплячих рідин до високонагрітих апаратів. Заходи профілактики.
7. Розрахункове визначення приросту тиску у високонагрітому апараті при попаданні до нього рідини з низькою температурою кипіння.
8. Розрахункове визначення приросту тиску за умов порушення процесу конденсації парів.
9. Основні пожежно-профілактичні заходи, що зменшують можливість утворення підвищених тисків.
10. Види динамічних впливів на апарати та трубопроводи, в чому їх небезпека?
11. Як визначити тиск при гідравлічному ударі в трубопроводі? Навести формулу.
12. Основні заходи, що запобігають утворенню динамічних впливів на апарати та трубопроводи.
13. Запобіжні клапани, класифікація, влаштування та принцип дії.
14. Написати та пояснити формулу для визначення пропускної спроможності запобіжного клапана.
15. Ерозія матеріалу апаратів та трубопроводів. Види ерозії та небезпека її виникнення.
16. Причини появи температурних перенапружень в матеріалі апаратів та трубопроводів.
17. Як визначити температурні напруження для жорстко закріпленої конструкції апаратів та трубопроводів?
18. Температурні компенсатори. Принцип їх роботи.
19. В чому полягає небезпека впливу високих температур на матеріал апаратів? Заходи, що зменшують небезпечний вплив високих температур на стінки апаратів.
20. Причини пошкодження апаратів від впливу низьких температур. Заходи, що зменшують цю небезпеку.
21. Види корозії. Сутність кисневої, сірчаної та водневої корозії металів.
22. Сутність електрохімічної корозії металів.
23. Види корозійного руйнування.
24. Способи захисту металів від хімічної та електрохімічної корозії.
25. Сутність і схеми установок катодного та протекторного захисту споруд.
|